- 2017/2019- iNOVA4HEALTH Project 35: 2015\CEDOC\IPOLFG\IBET
Monócitos são promotores de angiogénese em cancro - Nova aplicação para fármacos antigos.
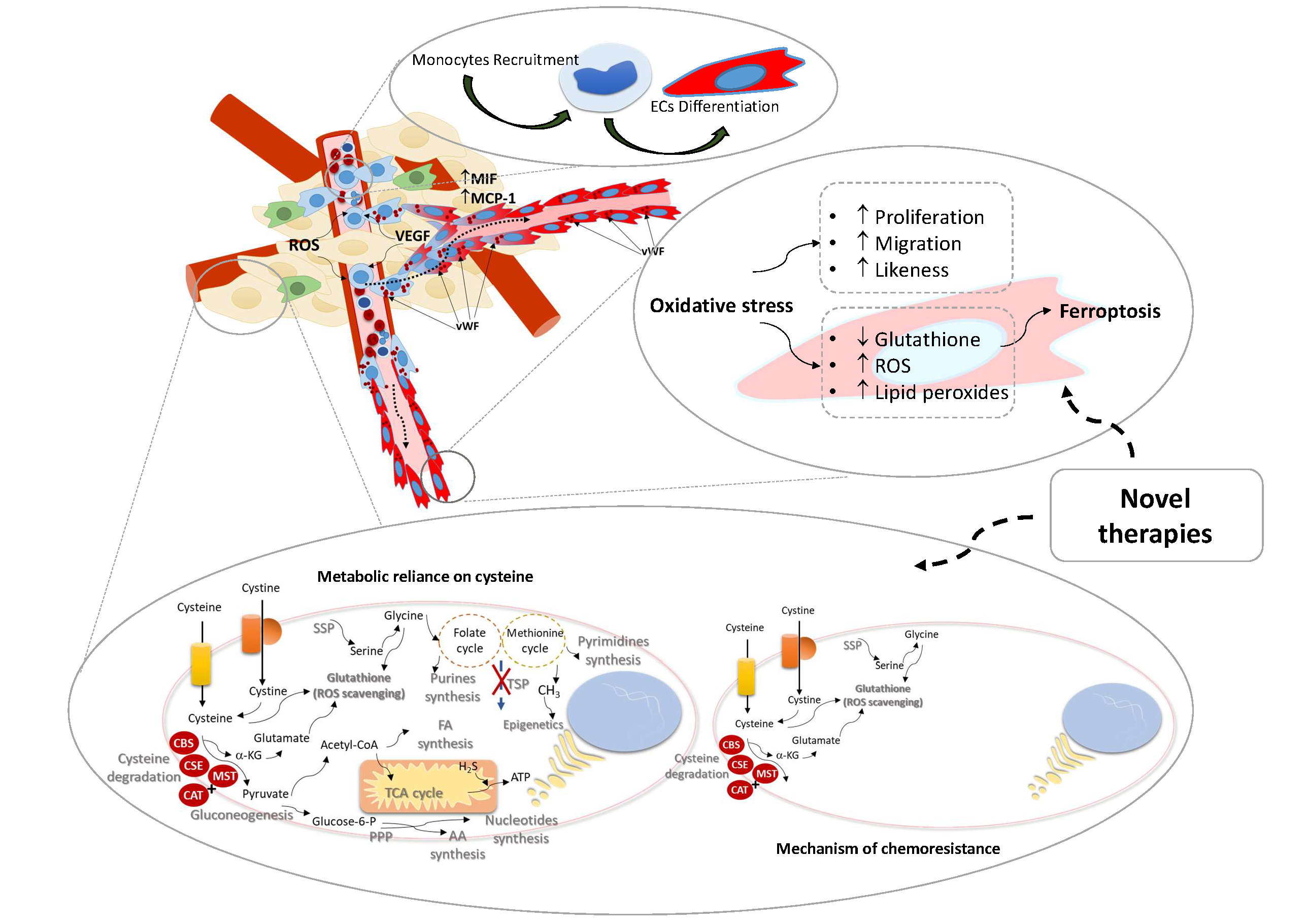
O papel dos monócitos como precursores endoteliais não é um assunto novo em outras doenças, mas em cancro o assunto nunca foi verdadeiramente estudado. Estudos mostraram que um subconjunto de monócitos circulantes é capaz de diferenciar em células endoteliais (EC) in vitro, e incorporar vasos em tumores, in vivo. As espécies reativas de oxigênio (ROS) são relatadas como essenciais para a manutenção da homeostase do endotélio por atuarem como reguladores da sinalização intracelular.
Além disso, sabe-se que alguns fármacos (ex. β-bloqueadores), já aprovados para o uso humano, possuem simultaneamente um papel pró-apoptótico na EC e um papel modulador na diferenciação de monócitos.
A nossa hipótese é que os monócitos são importantes precursores endoteliais e a manipulação do stress oxidativo com o uso de alguns fármacos pode ser uma nova arma no controlo da angiogénese tumoral.
Os principais objetivos são validar os monócitos como precursores endoteliais, desvendar o papel do stress oxidativo na angiogénese e aproveitar o estado redox para controlar o crescimento dos vasos.
Publicações:
Lopes-Coelho F, Silva F, Hipólito A, Mendes C, Sequeira CO, Pires RF, Almeida AM, Bonifácio VDB, Pereira SA, Serpa J. The activation of endothelial cells relies on a ferroptosis-like mechanism: novel perspectives in management of angiogenesis and cancer therapy. Front. Oncol., 10 May 2021. doi:10.3389/fonc.2021.656229.
Lopes-Coelho F, Silva F, Gouveia-Fernandes S, Martins C, Lopes N, Domingues G, Brito C, Almeida AM, Pereira SA, Serpa J. Monocytes as Endothelial Progenitor Cells (EPCs), Another Brick in the Wall to Disentangle Tumor Angiogenesis. Cells. 2020 Jan 1;9(1):107. doi: 10.3390/cells9010107.
- 2015/2017- iNOVA4HEALTH Project 4: 2015\CEDOC\IPOLFG\IBET
Carcinoma do ovário é um bom modelo para definir o perfil metabólico como uma ferramenta para prever quimiorresistência.
EOC é um modelo natural para estudar a resistência à terapia. Aproximadamente 70% das doentes apresentam doença extra-ovária e, além da resposta inicial à terapia, mais de 60% apresentam recorrência da doença e a taxa de mortalidade é de 70-90%, principalmente devido à quimiorresistência.
O nosso grupo publicou um estudo que mostra que o metabolismo dos aminoácidos e a produção de glutatião estão na base da resistência intrínseca fo carcinoma de células claras à carboplatina (6).
Hipótese: As alterações no perfil metabólico induzidas pela exposição à quimioterapia podem ser uma ferramenta útil para prever, antecipar e anular a quimiorresistência em pacientes com câncer de ovário.
O objetivo principal é usar o modelo de carcinoma do ovário para avaliar o impacto da adaptação metabólica na quimiorresistência.
Publicações:
Nunes SC, Ramos C, Santos I, et al. Cysteine Boosts Fitness Under Hypoxia-Mimicked Conditions in Ovarian Cancer by Metabolic Reprogramming. Front Cell Dev Biol. 2021 Aug 11;9:722412. doi: 10.3389/fcell.2021.722412.
Santos I, Ramos C, Mendes C, et al.. Targeting Glutathione and Cystathionine β-Synthase in Ovarian Cancer Treatment by Selenium-Chrysin Polyurea Dendrimer Nanoformulation. Nutrients. 2019 Oct 19;11(10):2523. doi: 10.3390/nu11102523.
Nunes SC, Ramos C, Lopes-Coelho F, et al.. Cysteine allows ovarian cancer cells to adapt to hypoxia and to escape from carboplatin cytotoxicity. Scientific Reports. 2018 Jun 22;8(1):9513. doi: 10.1038/s41598-018-27753-y.
Nunes SC, Lopes-Coelho F, Gouveia-Fernandes S, et al.. Cysteine boosters the evolutionary adaptation to CoCl2 mimicked hypoxia conditions, favouring carboplatin resistance in ovarian cancer. BMC Evololutionary Biology 2018 Jun 19;18(1):97. doi: 10.1186/s12862-018-1214-1.